La temperatura:
La temperatura es la medida de la
energía térmica de una sustancia. Se mide con un termómetro. Las escalas más
empleadas para medir esta magnitud son la Escala Celsius (o centígrada) y la
Escala Kelvin. 1ºC es lo mismo que 1 K, la única diferencia es que el 0 en la
escala Kelvin está a - 273 ºC.
En la escala Celsius se asigna el
valor 0 (0 ºC) a la temperatura de congelación del agua y el valor 100 (100 ºC)
a la temperatura de ebullición del agua. El intervalo entre estas dos
temperaturas se divide en 100 partes iguales, cada una de las cuales corresponde
a 1 grado.
En la escala Kelvin se asignó el 0 a
aquella temperatura a la cual las partículas no se mueven (temperatura más baja
posible). Esta temperatura equivale a -273 ºC de la escala Celsius.
Para convertir ambas temperaturas,
tenemos que tener en cuenta que:
T (K) = t(ºC) + 273
La energía térmica:
La energía térmica es la energía
cinética (relacionada con el movimiento) media de un conjunto muy grande de
átomos o moléculas. Esta energía cinética media depende de la temperatura, que
se relaciona con el movimiento de las partículas (átomos y moléculas) que
constituyen las sustancias.
Calor y equilibrio térmico:
Cuando dos cuerpos a distintas
temperaturas se ponen en contacto, terminan igualando sus temperaturas. Entonces
se dice que se ha alcanzado el equilibrio térmico.
Cuando dos sistemas entran en
contacto, las partículas con mayor energía cinética transfieren, mediante
choques, parte de su energía a las restantes partículas, de manera que al final
la energía cinética media de todo el conjunto es la misma.
Cuando dos sistemas en desequilibrio
térmico entran en contacto, el de mayor temperatura transfiere energía térmica
al de menor temperatura hasta conseguir el equilibrio térmico.
El calor es la transferencia de
energía desde un cuerpo que se encuentra a mayor temperatura hasta otro de menor
temperatura. Cuando ambos cuerpos igualan sus temperaturas se detiene la
transmisión de energía.
Calor:
calor está definido como la forma de energía que se transfiere entre diferentes cuerpos o diferentes zonas de un mismo cuerpo que se encuentran a distintas temperaturas,
sin embargo en termodinámica generalmente el término calor significa
simplemente transferencia de energía. Este flujo de energía siempre
ocurre desde el cuerpo de mayor temperatura hacia el cuerpo de menor
temperatura, ocurriendo la transferencia hasta que ambos cuerpos se
encuentren en equilibrio térmico (ejemplo: una bebida fría dejada en una habitación se entibia).
La energía puede ser transferida por diferentes mecanismos de transferencia, estos son la radiación, la conducción y la convección,
aunque en la mayoría de los procesos reales todos se encuentran
presentes en mayor o menor grado. Cabe resaltar que los cuerpos no
tienen calor, sino energía térmica.
La energía existe en varias formas. En este caso nos enfocamos en el
calor, que es el proceso mediante el cual la energía se puede transferir
de un sistema a otro como resultado de la diferencia de temperatura.
Unidades de medida del calor
El calor se mide en unidades de energía. Por tanto, en el Sistema Internacional
su unidad es el julio (J). Sin embargo, la unidad tradicional para medir el
calor es la caloria (cal). La equivalencia es:
1 cal = 4,184 J ó 1 J = 0,24 cal
Conducción:
El proceso por el que se transmite calor de un punto a otro de un sólido se
llama Conducción.
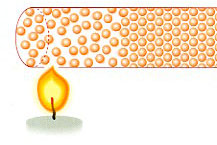
En la conducción se transmite energía térmica, pero no materia. Los átomos del
extremo que se calienta, empiezan a moverse más rápido y chocan con los átomos
vecinos transmitiendo la energía térmica.
Dilatación:
Se denomina dilatación térmica al aumento de longitud, volumen o alguna otra dimensión métrica que sufre un cuerpo físico debido al aumento de temperatura que se provoca en él por cualquier medio. La contracción térmica es la disminución de propiedades métricas por disminución de la misma.
Se denomina dilatación térmica al aumento de longitud, volumen o alguna otra dimensión métrica que sufre un cuerpo físico debido al aumento de temperatura que se provoca en él por cualquier medio. La contracción térmica es la disminución de propiedades métricas por disminución de la misma.
CAMBIOS QUE PRIVOCA EL CALOR:
todos los dias ocurren cambios en la materia que nos rodea. Algunos hacen cambiar el aspecto, la forma y el estado. A estos cambios los llamaremos cambios fisicos de la materia.
poedemos distinguir dos tipos de cambios de estado segun sea su influencia del calor:
- Cambios progresivos
- Cambios regresivos
- Sublimación progresiva:
2. Fusión:
Es la transformación de un solidó en liquído al aplicarle calor. Esta temperatura específica para cada sustancia que se funde.
3.Evaporación:
Es la transformación de las partículas de superficie de un liquído, en gas por la acción del calor. Este cambio ocurre en forma normal a temperatura ambiente, e alhunas sustancias liquídas como el aguay alcohol.
4.Ebullición:
Es la tranformación de todas las particulas de liquído en gas por la acción del calor aplicado.
Cambios regresivos:
Se producen por el enfriamiento de los cuerpos. se distinguen tres tipos:
- sublimacion regresiva
- solidificación
- condenseción
Es el cambio de una sustancia de estado gaseoso a estado solido sin pasar por el estado liquido.
2. Solidicación:
Es el paso de una sustancia en estado liquído a solido.
3. Condensación:
Es el cambio de estado de una sustancia en estado gaseoso a estado liquído.
Es el proceso por el que se intercambia energía en forma de calor entre distintos cuerpos, o en diferentes partes de un mismo cuerpo que estan en distinto nivel energético.
El calor se transfiere mediante convección, radiación o conducción. Aunque estos procesos pueden tener lugar simultaneamente, puede ocurrir que uno de los mecanismos predomine sobre los otros dos.
1.La conducción requiere contacto físico entre los cuerpos que intercambian calor.
2. La radiación
No hace falta que los cuerpos esten en contacto ni que haya materia entre ellos.
Tipos de radiación:
3. La convección:
Se produce atravez del movimiento de un liquído o un gas en contacto con un cuerpo de temperatura diferente.
Tipos de convección:
- Convección forzada
- Convección libre
Leyes de Charles, Boyle y Gay Lussac:
Ley de Charles;
La ley de Charles establece que el
volumen y la temperatura son directamente proporcionales entre sí, siempre y
cuando se mantenga.
Ley de Boyle;
La ley de Boyle afirma que la presión y el volumen
son inversamente proporcionales entre si a temperatura constante.
Ley de Gay Lussac;
La ley de Gas Lussac introduce una
proporcionalidad directa entre la temperatura y la presión, siempre y cuando se
encuentre a un volumen constante.
Ecuacion del estado gaseoso y gases ideales:
ECUACIÓN GENERAL DE LOS GASES IDEALES
Partiendo de la ecuación de estado:
Donde «R» es la constante universal de los gases ideales luego para dos
estados del mismo gas, 1y 2














en general todo me parece exelente y creo q es una buena guia para realizar tareas de estos temas .. exelente trabaj
ResponderEliminargracias ulises y si si queremos que no quede mas claro ya sabes practicando ejemplos.
ResponderEliminarArbe muy buena información, en esta ocación te sacaste un 10! Muy entendible todo y demaciado ordenado.
ResponderEliminararbe todo muy bien.! felicidades.! =) todos los temas son muy entendibles.! gracias por la información
ResponderEliminarArbe la informacion es muy interesante los videos muy interesantes
ResponderEliminarok Graxi por comentar en mi bloc y ya saben a echarle ganas al estudio eh
ResponderEliminar